درک لیست اصطلاحات بالا برای درک مدیریت ریسک تجهیزات پزشکی بسیار مهم است. این اصطلاحات باید در فرهنگ لغات متخصصان تجهیزات پزشکی ریشه دوانده باشد.
هر طور که این را تفسیر کنید، باید آن را تخمین بزنید شدت آسیبی که می تواند از خطرات و موقعیت های خطرناک ناشی شود. سپس باید احتمال آن را تخمین بزنید وقوع از هر آسیب
با این حال، کسی باید برای این محتوا هزینه کند. و اینجاست که تبلیغات وارد میشود. بیشتر مردم تبلیغات را یک مزاحم میدانند، اما آنها علاوه بر اینکه به شرکتهای رسانهای اجازه میدهند سرپا بمانند، عملکرد مفیدی نیز دارند. آنها شما را از محصولات و خدمات جدید مرتبط با صنعت خود آگاه می کنند. همه تبلیغات در خلاصه کیفیت مستقیماً برای محصولات و خدماتی که اکثر خوانندگان ما به آن نیاز دارند اعمال شود. شما تبلیغات خودرو یا مکمل های سلامتی را نخواهید دید.
هنگامی که تمام مراحل ذکر شده در بالا مورد توجه قرار گرفت، باید به عنوان بخشی از گزارش مدیریت ریسک بررسی و مستندسازی شود.
تولید و پس از تولید
بله، ممکن است از ابزارهای دیگری مانند حالت شکست و تحلیل اثرات (FMEA) برای ثبت فعالیتهای مدیریت ریسک استفاده کنید. این ابزارها ممکن است اصطلاحات مشابهی داشته باشند، مانند:
• حالت های شکست
• علل
• انتقاد پذیری
• تشخیص
• شماره اولویت ریسک
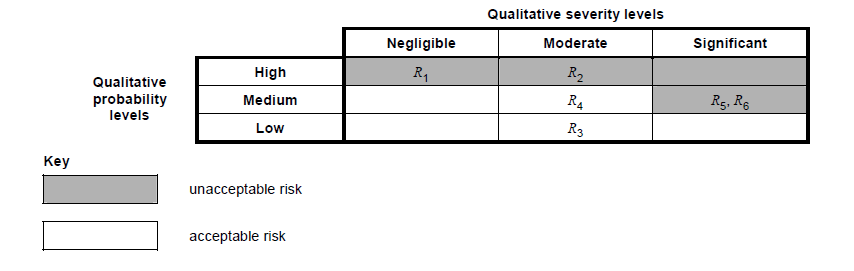
به بیان ساده، این یک روش بصری برای ارزیابی اینکه خطرات شما در رابطه با شدت و احتمال در کجا قرار می گیرند، است. می تواند به شما کمک کند که کدام خطرات قابل قبول و غیرقابل قبول هستند.
تجزیه و تحلیل سود-ریسک
ارزیابی ریسک ها و ریسک های باقیمانده برای خطرات فردی و موقعیت های خطرناک کافی نیست. همچنین باید کل دستگاه پزشکی و پذیرش کلی ریسک باقیمانده را ارزیابی کنید. ممکن است خطرات مرتبط با خطرات فردی قابل قبول باشد، اما ممکن است کل محصول قابل قبول نباشد. در هر صورت، باید ارزیابی و مستندسازی کنید که آیا محصول با معیارهای مقبولیت تعریف شده توسط شرکت مطابقت دارد یا خیر.
گاهی اوقات کنترل ریسک اضافی عملی نیست. در این موارد، شما فرصتی دارید که یک تجزیه و تحلیل سود-ریسک انجام دهید، که در آن مزایای پزشکی دستگاه خود و خطرات باقیمانده را مقایسه کنید.
برای شما آسان خواهد بود که در دام بیفتید که این اصطلاحات دیگر از سایر ابزارهای ریسک شما به اندازه کافی به ISO 14971 نزدیک هستند که کم و بیش یکسان باشند. آنها نیستند. لطفا در این دام نیفتید.
این اینفوگرافیک مستقیماً به صورت یک به یک با استاندارد هماهنگ می شود. وقتی اجازه دهید این برای یک یا دو دقیقه خیس بخورد، می توانید ببینید که چگونه این تصویر می تواند و باید پایه ای برای فرآیند مدیریت ریسک داخلی شرکت شما شود.
بخش 3 ISO 14971 فهرست جامعی از اصطلاحات و تعاریف کلیدی مربوط به مدیریت ریسک را ارائه می دهد. به خاطر زمان، قرار نیست هر ترم را طی کنم. با این حال، من چند تعریف کلیدی را به اشتراک میگذارم:
• ریسک: ترکیبی از احتمال وقوع آسیب و شدت آن آسیب
• خطر: یک منبع بالقوه آسیب
• وضعیت خطرناک: شرایطی که در آن افراد، اموال یا محیط در معرض یک یا چند خطر قرار می گیرند.
• آسیب: صدمه جسمی یا آسیب به سلامت افراد، یا آسیب به اموال یا محیط زیست
• شدت: اندازه گیری پیامدهای احتمالی یک خطر
• تجزیه و تحلیل ریسک: استفاده سیستماتیک از اطلاعات موجود برای شناسایی خطرات و برآورد خطر
• تخمین ریسک: فرآیندی که برای تخصیص مقادیر به احتمال وقوع آسیب و شدت آن آسیب استفاده می شود.
• ارزیابی ریسک: فرآیند مقایسه ریسک برآورد شده با معیارهای ریسک داده شده برای تعیین قابل قبول بودن ریسک
• ارزیابی ریسک: فرآیند کلی شامل تحلیل ریسک و ارزیابی ریسک
• کنترل ریسک: فرآیندی که در آن تصمیمات اتخاذ می شود و اقداماتی انجام می شود که به وسیله آن ریسک ها به سطوح مشخص کاهش می یابد یا حفظ می شوند.
• ریسک باقیمانده: ریسک باقی مانده پس از انجام اقدامات کنترل ریسک
ISO 14971 یک استاندارد خوب است: آموزنده، توصیفی و آسان (به اندازه کافی) برای درک. مهمترین، این استاندارد مدیریت ریسک برای صنعت تجهیزات پزشکی است.
مراقبت های بهداشتی
آشنایی با مدیریت ریسک تجهیزات پزشکی ISO 14971
با فرآیندهای صحیح، لازم نیست چرخ را دوباره اختراع کنید
اولین بار در 11 مه 2023 منتشر شد وبلاگ گرین لایت گورو.